Nová farmaceutická legislatíva sľubuje dostupnejšie lieky

Európska komisia predstavila dlho očakávaný návrh revízie európskej farmaceutickej legislatívy. Má sa jednať o najväčšiu reformnú zmenu v tejto oblasti za posledných dvadsať rokov. Jej cieľom nie je len zvýšenie miestnej a cenovej dostupnosti liečivých prípravkov pre všetkých občanov Európskej únie, ale taktiež posilnenie vývoja inovatívnych liekov a konkurencieschopnosti Európy na globálnom trhu s liekmi. Legislatívne návrhy budú teraz predložené Európskemu parlamentu a Rade. Ozýva sa však aj prvá kritika zainteresovaných strán.
Súčasná farmaceutická legislatíva je už obsolentná, jej reforma prichádza po dlhých rokoch a je tak trochu vynútenou reakciou na súčasné problémy, ktoré sa prejavujú nielen znižujúcim sa podielom Európy na globálnej produkcii inovatívnych liečiv, ale tiež relatívne pomalým a nerovnakým prístupom pacientov k najmodernejším liekom v rámci jednotlivých krajín Európskej únie. Podľa dát nedávno prezentovaných Európskou federáciou farmaceutického priemyslu a asociácií (EFPIA) v Európe v súčasnosti vzniká iba 22 percent z celkového objemu inovatívnych liečiv, čo vynikne predovšetkým v kontraste so Spojenými štátmi americkými, kde je to 48 percent. Značné medzery máme podľa Európskej komisie ako v riešení nenaplnených zdravotných potrieb, vzácnych ochorení, tak aj v boji proti antimikrobiálnej rezistencii, ktorou sa Európska komisia v rámci tejto legislatívy taktiež zaoberá. Vysoké ceny inovatívnych liečiv a nedostatok liekov sú pretrvávajúcim problémom ako pre európskych pacientov, tak pre jednotlivé systémy zdravotnej starostlivosti. Pokiaľ má Európa aj naďalej zostať atraktívnym miestom pre investície a udržať si pozíciu jedného z lídrov vo vývoji liečiv, musí podľa Európskej komisie prispôsobiť svoje pravidlá digitálnej transformácii a novým technológiám a v súlade s názorom farmaceutických firiem tiež obmedziť byrokraciu a celkovo zjednodušiť postupy sprevádzajúce vývoj, schvaľovacie procesy a uvádzanie nových liekov na trh. Nové pravidlá by podľa Európskej komisie taktiež mali rešpektovať dopady výroby liekov na životné prostredie. „Dnes k našej Európskej zdravotníckej únii pridávame ďalší ústredný pilier. Predkladáme návrhy, aby sme zaistili, že sa lieky k pacientom po celej Európe dostanú včas a spravodlivo. Je to reforma, ktorá zaisťuje, že Európa zostane atraktívna pre podnikanie a náš farmaceutický priemysel bude globálnou inovačnou veľmocou. Vybudovanie jednotného trhu s liekmi je nutnosťou ako pre našich občanov, tak pre naše spoločnosti,“ komentovala predstavenie návrhov komisárka pre zdravie a bezpečnosť potravín Stella Kyriakidesová.
Hlavné ciele revízie liekovej legislatívy
Predstavený návrh revízie farmaceutickej legislatívy vychádza z Farmaceutickej stratégie pre Európu, ktorú predstavila Európska komisia už v novembri 2020. Jej cieľom bolo vytvorenie takého farmaceutického prostredia, ktoré bude odolné voči kríze, bude silno orientované na pacienta a farmaceutický priemysel Európskej únie bude mať dostatok priestoru pre inovácie, vďaka čomu bude konkurencieschopný v rámci globálneho trhu. Reforma legislatívy zahŕňa návrhy nových smerníc a nariadení, ktoré revidujú súčasné právne predpisy, a to vrátane právnych predpisov o pediatrických liekoch a liekoch na vzácne ochorenia.
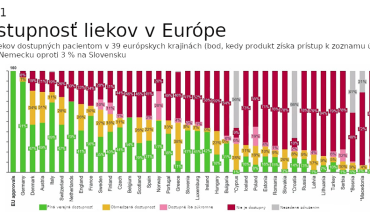 Nové pravidlá by mali napomôcť vytvoriť jednotný trh s liekmi, ktorý podľa Európskej komisie zabezpečí, že všetci pacienti v celej Európskej únii budú mať včasný, spravodlivý a cenovo dostupný prístup k bezpečným a účinným liekom. V oblasti výskumu a vývoja liekov by mal vzniknúť celý nový „ekosystém“, ktorý bude pre firmy v Európe atraktívny a bude podporovať inovácie. Tomu by malo dopomôcť taktiež výrazné zníženie administratívnej záťaže a urýchlenie procesu schvaľovania nových liekov, ktoré sa potom tiež dostanú rýchlejšie k pacientom. Nová legislatíva má riešiť aj obrovskú nerovnosť, ktorá panuje v dostupnosti liekov v rámci jednotlivých krajín Európskej únie. Lieky by mali byť naďalej dostupné pre pacientov bez ohľadu na to, kde žijú. Súčasné rozdiely v dostupnosti v jednotlivých krajinách znázorňujú grafy 1 a 2. Návrhy novej legislatívy reflektujú tiež boj s antimikrobiálnou rezistenciou či udržateľnosť z pohľadu životného prostredia.
Nové pravidlá by mali napomôcť vytvoriť jednotný trh s liekmi, ktorý podľa Európskej komisie zabezpečí, že všetci pacienti v celej Európskej únii budú mať včasný, spravodlivý a cenovo dostupný prístup k bezpečným a účinným liekom. V oblasti výskumu a vývoja liekov by mal vzniknúť celý nový „ekosystém“, ktorý bude pre firmy v Európe atraktívny a bude podporovať inovácie. Tomu by malo dopomôcť taktiež výrazné zníženie administratívnej záťaže a urýchlenie procesu schvaľovania nových liekov, ktoré sa potom tiež dostanú rýchlejšie k pacientom. Nová legislatíva má riešiť aj obrovskú nerovnosť, ktorá panuje v dostupnosti liekov v rámci jednotlivých krajín Európskej únie. Lieky by mali byť naďalej dostupné pre pacientov bez ohľadu na to, kde žijú. Súčasné rozdiely v dostupnosti v jednotlivých krajinách znázorňujú grafy 1 a 2. Návrhy novej legislatívy reflektujú tiež boj s antimikrobiálnou rezistenciou či udržateľnosť z pohľadu životného prostredia.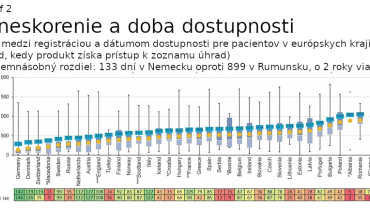
Ako dostať lieky včas ku všetkým pacientom?
 Medzi kľúčové prvky návrhu (pozri QR kód) patria podľa Európskej komisie napríklad nové stimuly, ktoré by mali motivovať farmaceutické spoločnosti, aby sprístupnili svoje lieky všetkým pacientom Európskej únie a zamerali sa obzvlášť na vývoj produktov, ktoré riešia nenaplnené zdravotné potreby. Pacientom by tiež mali byť skôr dostupné generické a biosimilárne liečivé prípravky a zjednodušené postupy ich registrácie. „Jedným z opatrení je skrátenie dĺžky exkluzivity nových molekúl zo súčasných ôsmich rokov na šesť rokov v prípade, že výrobca nedodá inovatívne liečivo na všetky trhy v Európskej únii. Momentálne táto osemročná ochrana exkluzívneho prístupu na trh takúto podmienku nemá, čo podľa Európskej komisie vedie k tomu, že výrobcovia nie sú motivovaní k dodávkam liekov všetkým pacientom v Európskej únii a na niektoré menšie trhy začnú dodávať s niekoľkoročným oneskorením,“ vysvetľuje Česká asociácia farmaceutických firiem (ČAFF) v reakcii na oznámenie revízie liekovej legislatívy s tým, že súčasná osemročná ochranná lehota, ktorá platí v Európe, je najdlhšia na svete. Podľa návrhu by však mohli farmaceutické firmy získať oproti súčasným 11 rokom o rok dlhšiu dodatočnú ochranu nového lieku. Až 12 rokov by bol liek „chránený“, pokiaľ by bol určený k terapii ochorenia, ktoré doposiaľ nebolo účinne liečiteľné, alebo v prípade, že sú uskutočňované porovnávacie štúdie, čo uľahčí aj porovnávanie nákladovej efektivity liekov, alebo pokiaľ je vyvinutá nová terapeutická indikácia. „Zámer Komisie bol jednoduchý – motivovať farmaceutický priemysel k tomu, aby sústredil výskum a vývoj na doposiaľ neuspokojené potreby medicíny a zároveň aby spoločnosti dodávali liek na celý únijný trh. Komisia ale nijako nerieši ceny liekov a zaraďovanie liekov do národných systémov zdravotného poistenia. A tam je kameň úrazu. Firma môže nadovšetko chcieť uviesť liek na niektorý trh, ale pokiaľ v menších štátoch s prísnymi úhradovými pravidlami nie je ochota regulačných autorít a zdravotných poisťovní liek do systému vpustiť, pretože by ho museli poistencom hradiť, na čo nemajú dosť peňazí, situácia nemá riešenie,“ poznamenal výkonný riaditeľ ČAFF Filip Vrubel.
Medzi kľúčové prvky návrhu (pozri QR kód) patria podľa Európskej komisie napríklad nové stimuly, ktoré by mali motivovať farmaceutické spoločnosti, aby sprístupnili svoje lieky všetkým pacientom Európskej únie a zamerali sa obzvlášť na vývoj produktov, ktoré riešia nenaplnené zdravotné potreby. Pacientom by tiež mali byť skôr dostupné generické a biosimilárne liečivé prípravky a zjednodušené postupy ich registrácie. „Jedným z opatrení je skrátenie dĺžky exkluzivity nových molekúl zo súčasných ôsmich rokov na šesť rokov v prípade, že výrobca nedodá inovatívne liečivo na všetky trhy v Európskej únii. Momentálne táto osemročná ochrana exkluzívneho prístupu na trh takúto podmienku nemá, čo podľa Európskej komisie vedie k tomu, že výrobcovia nie sú motivovaní k dodávkam liekov všetkým pacientom v Európskej únii a na niektoré menšie trhy začnú dodávať s niekoľkoročným oneskorením,“ vysvetľuje Česká asociácia farmaceutických firiem (ČAFF) v reakcii na oznámenie revízie liekovej legislatívy s tým, že súčasná osemročná ochranná lehota, ktorá platí v Európe, je najdlhšia na svete. Podľa návrhu by však mohli farmaceutické firmy získať oproti súčasným 11 rokom o rok dlhšiu dodatočnú ochranu nového lieku. Až 12 rokov by bol liek „chránený“, pokiaľ by bol určený k terapii ochorenia, ktoré doposiaľ nebolo účinne liečiteľné, alebo v prípade, že sú uskutočňované porovnávacie štúdie, čo uľahčí aj porovnávanie nákladovej efektivity liekov, alebo pokiaľ je vyvinutá nová terapeutická indikácia. „Zámer Komisie bol jednoduchý – motivovať farmaceutický priemysel k tomu, aby sústredil výskum a vývoj na doposiaľ neuspokojené potreby medicíny a zároveň aby spoločnosti dodávali liek na celý únijný trh. Komisia ale nijako nerieši ceny liekov a zaraďovanie liekov do národných systémov zdravotného poistenia. A tam je kameň úrazu. Firma môže nadovšetko chcieť uviesť liek na niektorý trh, ale pokiaľ v menších štátoch s prísnymi úhradovými pravidlami nie je ochota regulačných autorít a zdravotných poisťovní liek do systému vpustiť, pretože by ho museli poistencom hradiť, na čo nemajú dosť peňazí, situácia nemá riešenie,“ poznamenal výkonný riaditeľ ČAFF Filip Vrubel.
Zjednodušenie regulácie
Európska komisia chce podporiť inovácie a konkurencieschopnosť tým, že celý regulačný rámec zjednoduší a vytvorí prostredie priateľské k inováciám a vývoju nových liečiv. „Európska lieková agentúra poskytne lepšiu včasnú regulačnú a vedeckú podporu vývojárom nádejných liečiv, aby uľahčila rýchle schválenie a pomohla tak malým a stredným podnikom a neziskovým vývojárom,“ uviedla v správe Európska komisia. Zrýchliť by sa malo aj vedecké hodnotenie a povoľovanie liečiv. V súčasnej dobe trvá schválenie lieku v priemere 400 dní, nové schvaľovacie postupy Európskej liekovej agentúry (EMA) počítajú so 180 dňami. Celková regulačná záťaž by sa mala vďaka zjednodušeniu postupov a digitalizácii významne znížiť, a to pri zachovaní najvyšších štandardov kvality, účinnosti a bezpečnosti liečiv.
Návrhy pod paľbou kritiky
Novelizácia európskej liekovej legislatívy je podľa zainteresovaných strán jednou z najdôležitejších európskych zdravotníckych tém za posledných dvadsať rokov. Jej finálne schválenie sa však môže ešte značne skomplikovať, a to aj kvôli výhradám, ktoré sa po jej zverejnení objavili v odborných kruhoch, a s ohľadom na skutočnosť, že Európu čakajú v blízkej dobe voľby, a teda aj obmena Európskeho parlamentu. „Komisia prichádza s návrhom nového liekového práva s oneskorením. Ambiciózne plány sa premietli do mnohých celkom nových opatrení, z ktorých niektoré sú predmetom kritiky naprieč zainteresovanými stranami. Je tak otázkou, či sa podarí text finálne schváliť ešte pred budúcimi voľbami do Európskeho parlamentu, ktoré sú už o rok. V opačnom prípade sa všetko môže ešte viac zdržať,“ hovorí k návrhu Filip Vrubel, ktorý zastupuje výrobcov generických a biosimilárnych liečiv. Výrobcovia generík síce vnímajú novelizáciu liekových predpisov ako krok dopredu, v určitých ohľadoch sú ale pomerne skeptickí. „Skrátenie ochrany originálneho prípravku o dva roky sa nemusí vôbec prejaviť na skoršom vstupe lacnejších generík na trh, pokiaľ sa nevyrieši umelé predlžovanie patentovej ochrany,“ domnieva sa predseda predstavenstva ČAFF a riaditeľ spoločnosti Sandoz Jiří Hanzlík. „Pokiaľ si firma v dobe, kedy už originálny liek dodáva na trh, zapíše nejaký nový patent súvisiaci s daným produktom, jeho výrobou alebo špecifickým zložením, môže tým zabrániť vstupu generika na ďalšie roky. A aj keď sa následne na súde preukáže, že takýto patent neobstojí, po celú dobu trvania súdu nie je možné generikum uvádzať na trh, čo poškodzuje nielen generickú firmu, ale aj pacientov a rozpočty zdravotných poisťovní,“ dodáva Hanzlík.
Kritickí k pasážam upravujúcim ochranné lehoty sú samozrejme tiež zástupcovia inovatívneho farmaceutického priemyslu. Podľa výkonného riaditeľa Asociácie inovatívneho farmaceutického priemyslu (AIFP) Davida Kolářa prináša novelizácia množstvo vítaných zmien, ako napríklad zefektívnenie regulačného rámca, zrýchlenie rozhodovacieho procesu pri vstupe nových liekov či boj proti antimikrobiálnej rezistencii. Inováciám však údajne nenahráva tak, ako si tvorcovia návrhov predstavovali. „Obsahuje výrazné oslabenie európskych inovačne-výskumných aktivít, ktorých posilnenie malo byť jedným z pôvodných zámerov novelizácie. Zároveň návrh stále nedostatočne rieši dostupnosť liečiv pre európskych pacientov. Dovolím si uviesť dva príklady. Prvým z nich je de facto skrátenie nástrojov ochrany duševného vlastníctva inovatívnych liečivých prípravkov o dva roky. Ochrana práv duševného vlastníctva je jediným mechanizmom, ktorý umožňuje návratnosť investícií do inovácií. Nedokážem si predstaviť scenár, v ktorom by jej zúženie viedlo k zamýšľanému cieľu, t. j. k zvýšeniu atraktivity Európy z pohľadu inovácií,“ mieni Kolář, podľa ktorého tento krok naopak znižuje konkurencieschopnosť Európy voči ostatným štátom. Oslabenie ochrany duševného vlastníctva povedie podľa výkonného riaditeľa AIFP ku spomaleniu investičných aktivít v Európskej únii a prehĺbeniu problémov, s ktorými Európa zápasí na globalizovanom trhu. AIFP sa ďalej nepozdáva ani skutočnosť, že by predĺženie ochrany duševného vlastníctva nového lieku malo byť podmienené uvedením vo všetkých 27 členských štátoch do dvoch rokov od jeho registrácie. „S ohľadom na rozdielne zdravotné systémy, a teda aj rozdielny prístup k stanoveniu cien a úhrad v krajinách EÚ je táto požiadavka a priori nesplniteľná. O vstupe liečivého prípravku na konkrétne európske trhy rozhodujú jednotlivé národné štáty. Zlepšenie dostupnosti liečiv pre pacientov týmto nástrojom je iluzórne,“ argumentuje David Kolář s tým, že navrhovaná novelizácia predpisov neponúka dostatočnú podporu inovatívnemu priemyslu. „Domnievam sa, že revízia farmaceutických právnych predpisov a patentového balíčku by mala odpovedať potrebám pacientov, realite európskych zdravotných systémov a priniesť potrebnú podporu európskeho inovačného prostredia. Od tohto stavu sme ale v túto chvíľu veľmi ďaleko,“ uzatvára.